Уравнение состояния:
pV=NkT - уравнение состояния (уравнение Менделеева- Клайперона)
pV=(m/M)RT,
R=8,31 Дж/(моль*К)
N = vNA; v = m / μ; N = m / m0;
p = 1/3 m0nv2 - основное уравнение молекулярно- кинетической теории.
p = p1 + p2 +…+pn - закон Дальтона для давления смеси газов.
n = N / V, p=nkT ;
при N=const => pV / T = const;
| T=const | изотерма | PV=const | закон Бойля-Мариотта |
| p=const | изобара | V/T=const | закон Гей-Люсака |
| V=const | изохора | p/T=const | закон Шарля |
Броуновское движение:
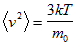 - среднеквадратичная скорость молекул.
- среднеквадратичная скорость молекул.
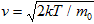 - наиболее вероятная скорость молекул.
- наиболее вероятная скорость молекул.
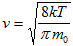 - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
Термодинамика:
ΔU = ΔQ - A - первое начало термодинамики.
A = pΔV - работа газа.
Теплоемкость C = ΔQ / ΔT, удельная теплоемкость с=С/m.
| Назв. | Опред. | Уравнение | A | Q | C |
| Изохора | V=const | Q=ΔU | 0 | NkΔT/(γ-1) | Nk/(γ-1) |
| Изобара | p=const | ΔU=Q+pΔV | pΔV | γpΔV/(γ-1) | γNk/(γ-1) |
| Изотерма | T=const | Q=A | NkT ln(V1 / V2) | A | беск |
| Адиабата | Q=const | ΔU=-A | 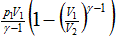
| 0 | 0 |
Тепловой баланс:
Qотд=Qполуч
Q=cmΔT - теплота на нагрев (охлаждение)
Q=rm - Теплота парообразования (конденсации)
Q=λm - плавление (кристаллизация)
Q=qm - сгорание.
Тепловое расширение:
l=l0(1+αΔT) V=V0(1+βΔT)
Тепловые машины:
η = A / Q - коэффициент полезного действия
η = (Qн – Qх) / Qн;
ηmax = (Tн – Tх) / Tн
Гидростатика, гидродинамика:
p = Fдавл / S
p = ρgh (давление на глубине h).
ρ = m / V - плотность.
FA = ρжид g Vтела ( сила Архимеда ).
ρh = const - закон сообщающихся сосудов.
ρSv = const - уравнение неразрывности.
ρv2 / 2 + ρgh + p = const - уравнение Бернулли (ρv2 / 2- динамическое, p - статическое, ρgh - гидростатическое давление.)
Fп.н = σl Eп.н = σS - сила и энергия поверхностного натяжения.
h = 2σ / (ρgh) - высота подъема жидкости в капилляре.

